肺癌研究黄金搭档——自发肿瘤小鼠和肺癌移植瘤小鼠如何选择?哪款更合适?
在2025年美国癌症研究协会(AACR)年会上,公布了Zoldonrasib(RMC-9805)在KRAS G12D突变非小细胞肺癌(NSCLC)中的显著疗效。作为全球首款针对KRAS G12D的抑制剂,它成功攻克了长期困扰临床的难题,且初步研究数据令人振奋,成为肺癌领域最具里程碑意义的成果。
肺癌在我国各类癌症种的发病率以及死亡率中均排在首位。根据2024年国家癌症中心发布的统计数据显示[1]:2022年,我国癌症新发病例总数达482.47万,其中肺癌新发病例数为106.06万,约占全部癌症新发病例的22.0%;肺癌死亡病例数为73.33万,在2022年总257.42万癌症死亡病例中占比高达28.5%。
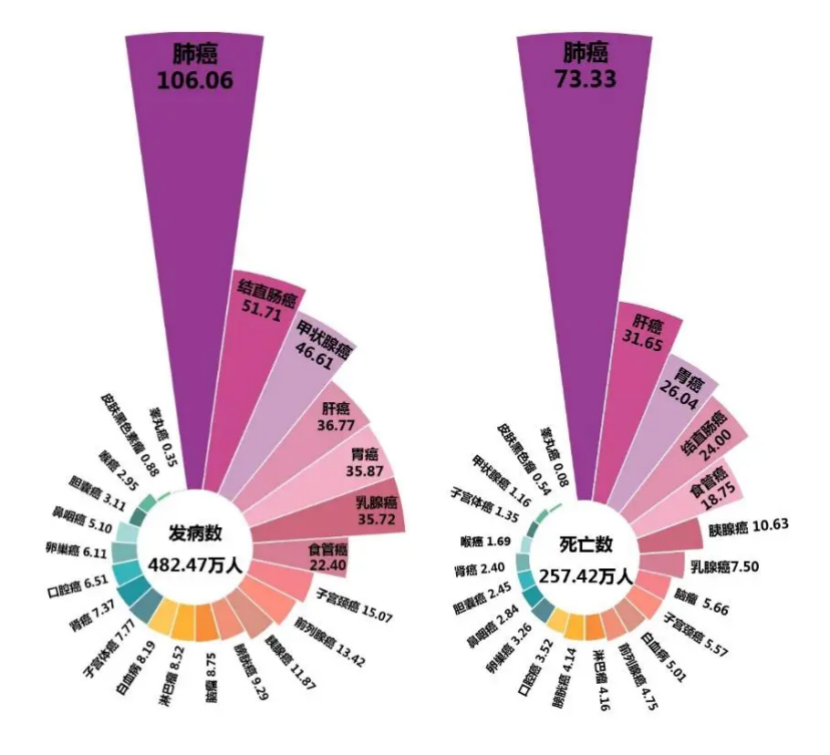
Illustration: J Natl Cancer Cent. 2024, 4(1): page
肺癌素有 “癌症之王” 的称号,其治疗策略一直是医学研究领域的重点与热点。接下来,我们将深入探寻肺癌的奥秘,了解它的类型与分期、药物治疗手段,以及在肺癌研究中发挥着关键作用的自发肿瘤小鼠模型等知识。
1. 肺癌的类型与分期
1.1 肺癌的类型
肺癌在医学分类上主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两大类。其中非小细胞肺癌是肺癌的主要类型,约占肺癌总诊断病例的80%~85%。[11]
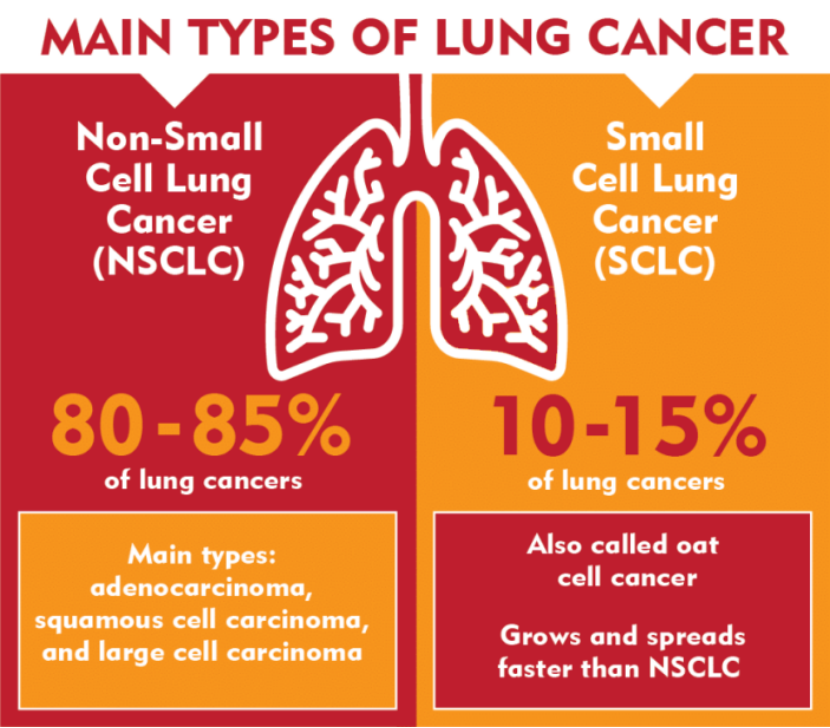
Illustration: Merit Medical
非小细胞肺癌还能够进一步细分,涵盖腺癌、鳞癌和大细胞癌等多种亚型。在这些亚型中,腺癌最为常见,鳞状细胞癌的发病比例次之。在非小细胞肺癌患者群体中,常见的驱动基因突变包括EGFR突变、KRAS突变、ALK融合、ROS1融合、HER2突变、MET扩增、BRAF突变等。而小细胞肺癌的发展,通常与Rb和p53基因功能缺失这一驱动基因突变密切相关。
1.2 肺癌的分期
肺癌分期对于准确判断肺癌的进展程度和扩散范围至关重要,是临床医生制定个性化治疗方案以及评估患者预后情况的重要依据。
目前,TNM分期系统在国际上被广泛应用于恶性肿瘤的分期,同时也适用于肺癌的分期评估。[3,4]
T(原发肿瘤):主要描述肿瘤的大小和所在位置,分期从T1到T4。T后的数字越大,表明肿瘤体积越大或位置越靠近中央气道,对周围组织的侵袭越严重。
N(淋巴结转移):用于反映肿瘤是否已扩散到附近的淋巴结,分期从N0到N3。数字越大,意味着淋巴结转移的范围越广,患者的预后情况越差。
M(远处转移):用于判断肿瘤是否扩散到身体其他部位,如肝、脑、骨等,分期从M0到M1。一旦出现远处转移,即为晚期肺癌,治疗难度显著增加。
在明确患者的T、N、M分期数值后,整合这些信息即可确定患者的整体分期。
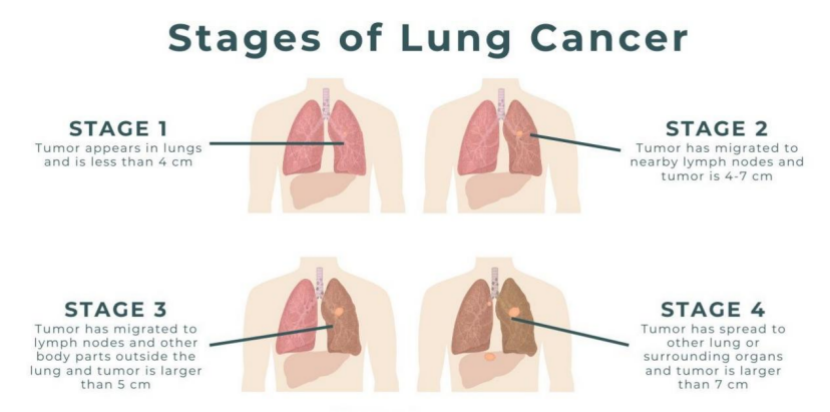
Illustration: Lung Cancer Center
尽管小细胞肺癌和非小细胞肺癌在专业分期系统上存在细微差别,但最终都能以0期、I期、II期、III期、IV期的形式来表示。基于TNM分期结果,医生能够为患者制定针对性的治疗策略。例如,早期肺癌(I期)通常首选手术切除;中期肺癌(II期、III期)可能需要采用手术联合放疗、化疗;而晚期转移性肺癌(IV期)的一线治疗则以系统抗癌药物为基础。具体方案取决于病理分型、分子分型和PD-L1状态等,旨在缓解患者症状、延长生存期。
2. 肺癌的药物治疗
随着医学的不断进步,肺癌的治疗手段日益丰富多样。如今,除了传统的放疗和化疗外,靶向治疗、免疫治疗等新型疗法也为肺癌患者带来了更多希望。[5,8]
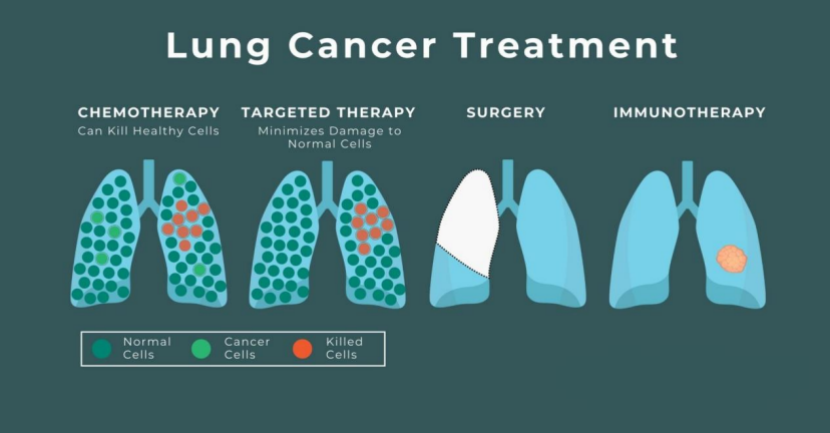
Illustration: Lung Cancer Center
化疗作为肺癌治疗的传统方法,主要通过细胞毒性药物来杀死癌细胞。在非小细胞肺癌的治疗中,常用的化疗方案包括铂类药物(如顺铂、卡铂)联合第三代化疗药物(如吉西他滨、紫杉醇等)。然而,这些化疗药物在杀伤癌细胞的同时,对正常细胞也存在一定的毒副作用。
分子靶向治疗是近年来肺癌治疗领域的重大突破。该治疗方式针对癌细胞特有的分子靶点,实现对癌细胞的精准打击,同时尽可能减少对正常细胞的损伤。例如,在非小细胞肺癌患者中,对于存在表皮生长因子受体(EGFR)突变的患者,可采用EGFR酪氨酸激酶抑制剂TKI(如奥希替尼、吉非替尼等)进行治疗。这些药物能够特异性地与 EGFR结合,阻断其信号传导通路,进而抑制癌细胞的生长和增殖,有效延长患者的生存期。
免疫治疗则是通过激活人体自身的免疫系统来识别和杀死癌细胞。近年来,免疫检查点抑制剂(如PD-1/PD-L1抑制剂)在肺癌治疗领域取得了显著成效。以帕博利珠单抗(PD-1抑制剂)为例,它能够通过阻断PD-1与PD-L1的结合,解除癌细胞对免疫细胞的抑制作用,使免疫细胞重新识别和攻击癌细胞,为晚期肺癌患者提供了全新的治疗选择。
3. 肺癌相关动物模型介绍
在癌症研究、抗癌药物研发以及临床前试验过程中,动物模型对于药物验证发挥着不可或缺的重要作用。它们为深入探究肺癌的发生机制、转移规律,以及筛选评估抗癌药物的疗效,提供了强有力的实验支撑。针对不同的临床研究目的,合理选择合适的动物模型,往往是决定研究成败的关键因素。下面,我们来了解一下肺癌研究中常用的小鼠模型。
3.1 肺癌自发肿瘤小鼠模型
肺癌自发肿瘤小鼠模型是借助基因工程技术,使小鼠在自然状态下自发形成肺部肿瘤的模型。该模型无需化学诱导或细胞移植过程,通过模拟特定基因突变或异常表达,能够高度还原人类肺癌发展过程,具备较高的生物学相似性和病理真实性。
KRAS突变
KRAS基因隶属于RAS基因家族,其编码的KRAS蛋白在细胞信号传递过程中发挥着核心作用。当KRAS基因发生突变后,编码产生的突变型KRAS蛋白会持续处于激活状态,促使肿瘤细胞不受控制地持续增殖,进而推动肿瘤的形成与发展。
在人类癌症病例中,KRAS基因突变广泛存在,超过20%的肺癌患者(大多为非小细胞肺癌)存在KRAS基因突变情况。[12]其中,97%的KRAS基因突变发生在第12号或者第13号氨基酸残基,主要表现为G12D、G12V、G12C、G12A、G13D这五种突变类型。使用表达 Cre 重组酶的重组腺病毒在小鼠肺部诱导 KRAS G12D、G12C表达可导致小鼠体内II 型肺泡细胞(AT2)增殖,与肺腺癌的发生密切相关。
亚星yaxing868官网针对KRAS突变开发了多种自发肿瘤小鼠模型。利用基因编辑技术对KRAS G12C和KRAS G12D进行改造,并通过与AT2 细胞特异性cre工具鼠配繁,使其自发形成肺癌。
部分验证数据如下:
B6-KS小鼠模型
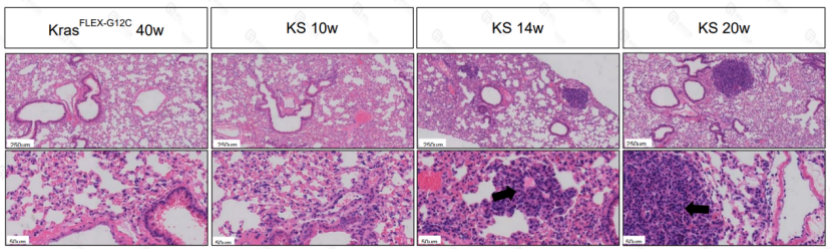
KS小鼠14w时肺癌高发(注:黑色箭头指示肿瘤细胞)
B6-KPS小鼠模型
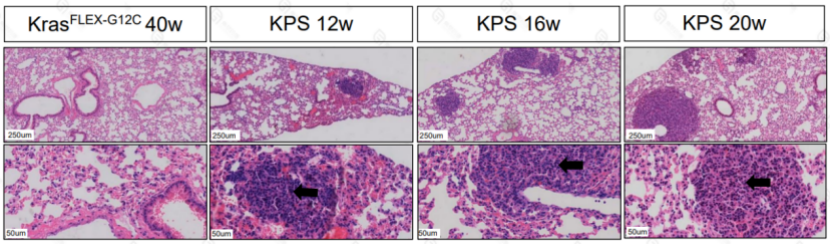
取KPS小鼠12-20w小鼠16只,检测肺癌发生情况,经病理数据统计全部小鼠自发肺部肿瘤
EGFR突变
EGFR致病性基因突变是导致肺癌发生的重要原因之一,且该突变在非小细胞肺癌患者中较为常见。在中国NSCLC患者群体中,EGFR突变率约为30%,其中腺癌患者的突变率高达50%左右[1]。EGFR突变主要包括4种常见类型:19号外显子缺失突变(19del)、21号外显子点突变(L858R、L861Q等)、18号外显子点突变(G719X)和20号外显子插入突变等。
针对EGFR敏感突变发挥作用的酪氨酸激酶抑制剂(TKI),如奥希替尼、吉非替尼等,已成为非小细胞肺癌临床治疗中最常应用的靶向治疗药物。研究人员正在探索开发新型的EGFR 抑制剂,以克服 C797S 突变引起的耐药问题,并通过个体化治疗策略来提高治疗效果。
亚星yaxing868官网针对EGFR突变构建了多种自发肿瘤小鼠模型,包括20号外显子T790M点突变、C797S突变及21号外显子L858R突变小鼠模型,以及外显子19缺失模型,感染Cre病毒后可自发肺癌表型。EGFR-L858R突变常引发呈支气管肺泡样表现的弥漫性肿瘤;而EGFR外显子19缺失,则多导致多灶性腺癌的出现。
部分验证数据如下:
B6-hEGFR-T790M-C797S-L858R小鼠模型
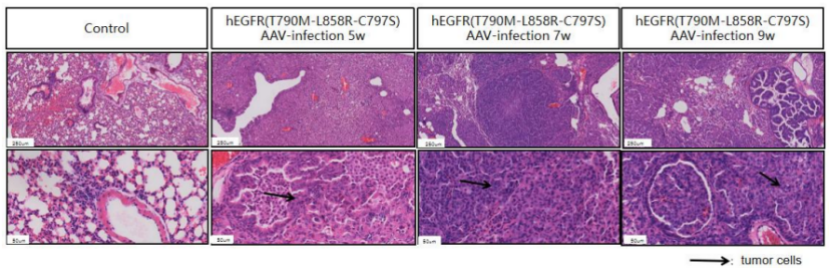
B6-hEGFR-T790M-C797S-L858R小鼠在AAV-Cre感染后的第5周、7周和9周肺部均已自发肿瘤
Trp53、Rb突变
Trp53基因是一类极为重要的肿瘤抑制基因,其编码的p53蛋白在细胞周期调控、DNA修复、细胞凋亡等多个关键生理过程中发挥着关键作用。然而,在肺癌等多种肿瘤疾病中,Trp53基因常常发生突变,突变后的p53蛋白不仅失去了原有的肿瘤抑制功能,甚至可能获得促进肿瘤发生发展的新功能,即“致癌功能”。 Rb作为重要的抑癌基因,能调控细胞周期。各种原因致其功能异常,都会让细胞持续过度增殖,进而引发肿瘤。研究发现,小鼠肺中Rb和P53的同时缺失会导致高发生率的小细胞肺癌(SCLC),且这种小鼠肺癌模型再现了人类小细胞肺癌的主要特征。[13]
亚星yaxing868官网开发了Trp53-flox和Rb1-flox 小鼠模型,交配后得到的子代在感染Cre病毒后可诱发肺部肿瘤,为深入探究肺癌的发生机制、开展肺癌药物筛选工作以及进行相关药效评估实验,提供了可靠工具。
3.2 肺癌移植瘤小鼠模型
小鼠移植瘤模型是研究肺癌的重要工具,为深入了解肺癌的发生机制、开展药物筛选及进行疗效评估提供了有力支撑。
异种移植瘤模型
① 人源肿瘤组织异种移植模型(PDX 模型)
PDX 模型是将患者手术切除的肿瘤组织直接移植到免疫缺陷小鼠体内,使其在小鼠体内生长形成肿瘤。该模型能够较好地保留患者肿瘤组织的原始病理特征和遗传多样性,能够高度模拟人类肺癌的生物学特性。在药物筛选方面,PDX模型可用于评估新型抗癌药物的疗效,预测药物在患者体内的反应。例如,研究人员可以将多种不同类型的肺癌 PDX模型分组,分别给予不同的药物进行治疗,通过比较各组小鼠肿瘤的生长抑制情况,筛选出对特定肺癌类型具有良好疗效的药物。
亚星yaxing868官网致力于推动肿瘤精准医学研究以及创新药物开发,构建了包含实体瘤与血液瘤多种类型的PDX动物模型资源库。其中,肺癌相关的PDX资源覆盖了非小细胞肺癌以及小细胞肺癌从早期到晚期的各个阶段,能够充分满足广大科研人员的研究需求。
| 分型 | 编号 | 分期 |
| 鳞癌 | LC00256 | ⅠA3(pT1 cN0 cM0) |
| LC00802 | pT2N0M0 | |
| LC00811 | pT2N0M0 | |
| LC00813 | T1cN0M0 | |
| LC00816 | T2N0M0 | |
| LC00873 | IB(ypT2N0M0) | |
| LC00904 | I | |
| LC00909 | IIIA(T4N0M0) | |
| LC00915 | IB(pT2aN0M0) | |
| LC00815 | ⅢB(pT3N2M0) | |
| 腺癌 | LC00143 | ⅡA(T2b N0 cM0) |
| LC00780 | ⅠA3(T1bN0M0) | |
| LC00784 | ⅢA(pT3N1M0) | |
| LC00785 | ⅠA2(pT1bN0M0) | |
| LC00800 | ⅡB(pT1cN1M0) | |
| LC00805 | ⅠA1(pT1aN0M0) | |
| LC00853 | IB(pT2aN0M0) | |
| LC00855 | IA2(T1bNOMO) | |
| LC00858 | IB(pT1bN1M0) | |
| LC00863 | IA3(pT1cNOMO) | |
| LC00869 | IB(pT2NOMO) | |
| LC00886 | IIB(pT2aN1MO) | |
| LC00889 | IA3(pT1cN0M0) | |
| LC00893 | IA2(pT1bNOMO) | |
| LC00901 | IIIB(pT3N2bM0) | |
| LC00916 | IB(pT2aN0M0) | |
| LC00818 | ⅠB(pT2aN0M0) | |
| LC00862 | IA3(pT1cNOMO) | |
| 小细胞癌 | LC00791 | limited-stage |
| LC00801 | ⅢA(pT2aN2M0) | |
| LC00842 | ⅡB(T2aN1M0) | |
| LC00861 | IB(pT2aN0M0) | |
| LC00872 | IIIA(T1bN2bM0) | |
| LC00824 | pT1cN0M0 | |
| 癌肉瘤 | LC00846 | IIIA(pT4N0M0) |
| 腺鳞癌 | LC00910 | IA3(pT1cN0M0) |
② 细胞系来源的异种移植瘤模型(CDX 模型)
CDX 模型是将人类肺癌细胞系接种到小鼠体内,使其生长形成肿瘤。这种方法操作相对简单,成本较低,且细胞系来源稳定,适合进行大规模的药物筛选和机制研究工作。例如,A549细胞系是一种常用的非小细胞肺癌细胞系,研究人员可将A549细胞接种到小鼠皮下,待肿瘤形成后,给予不同的药物处理,观察药物对肿瘤生长的影响,从而评估药物的抗肿瘤活性。
亚星yaxing868官网针对肿瘤医学研究和药物开发的实际需求,构建了完善的人源肿瘤细胞资源平台。其中,肺癌相关的CDX细胞系资源涵盖了野生型细胞系、荧光细胞系、耐药细胞系等,能够灵活满足行业多样化的研究需求。
| 产品编号 | 产品名称 | 产品类别 | 细胞来源 | 成瘤数据 |
| C000021 | A549 | 野生型细胞系 | 人源 | 有 |
| C000022 | Calu-3 | 野生型细胞系 | 人源 | 有 |
| C000023 | DMS 53 | 野生型细胞系 | 人源 | 有 |
| C000024 | HCC827 | 野生型细胞系 | 人源 | 有 |
| C000025 | NCI-H1666 | 野生型细胞系 | 人源 | 无 |
| C000026 | NCI-H1703 | 野生型细胞系 | 人源 | 有 |
| C000027 | NCI-H1755 | 野生型细胞系 | 人源 | 无 |
| C000028 | NCI-H1975 | 野生型细胞系 | 人源 | 有 |
| C000029 | NCI-H2122 | 野生型细胞系 | 人源 | 有 |
| C000030 | NCI-H226 | 野生型细胞系 | 人源 | 有 |
| C000031 | NCI-H292 | 野生型细胞系 | 人源 | 有 |
| C000032 | NCI-H358 | 野生型细胞系 | 人源 | 有 |
| C000033 | NCI-H446 | 野生型细胞系 | 人源 | 有 |
| C000034 | NCI-H460 | 野生型细胞系 | 人源 | 有 |
| C000035 | NCI-H526 | 野生型细胞系 | 人源 | 有 |
| C000036 | NCI-H727 | 野生型细胞系 | 人源 | 无 |
| C000037 | NCI-H82 | 野生型细胞系 | 人源 | 有 |
| C000038 | NCI-H441 | 野生型细胞系 | 人源 | 有 |
| C000039 | NCI-H69 | 野生型细胞系 | 人源 | 有 |
| C000040 | NCI-H1650 | 野生型细胞系 | 人源 | 有 |
| C000041 | SHP-77 | 野生型细胞系 | 人源 | 有 |
| C000042 | NCI-H1299 | 野生型细胞系 | 人源 | 有 |
| C000043 | PC-9 | 野生型细胞系 | 人源 | 有 |
| C000044 | NCl-H520 | 野生型细胞系 | 人源 | 无 |
| C000045 | NCI-H2228[H2228;H-2228] | 野生型细胞系 | 人源 | 有 |
| C000046 | SK-MES-1 | 野生型细胞系 | 人源 | 无 |
| C000047 | NCI-H838 | 野生型细胞系 | 人源 | 无 |
| C000048 | NCI-H1568 [H1568] | 野生型细胞系 | 人源 | 有 |
| C000049 | NCI-H209 [H209] | 野生型细胞系 | 人源 | 有 |
| C000050 | EBC-1 | 野生型细胞系 | 人源 | 有 |
| C000147 | Calu-6 | 野生型细胞系 | 人源 | 有 |
| C000188 | NCI-H2170 | 野生型细胞系 | 人源 | 有 |
| C000189 | NCI-H1975 | 野生型细胞系 | 人源 | 有 |
| C000200 | DV-90 | 野生型细胞系 | 人源 | 有 |
| C000209 | SW900 | 野生型细胞系 | 人源 | 无 |
| C000215 | NCI-H1944 | 野生型细胞系 | 人源 | 无 |
| C000216 | HCC-44 | 野生型细胞系 | 人源 | 无 |
| C000217 | NCI-H2073 | 野生型细胞系 | 人源 | 无 |
| C300020 | A549-Luc | 荧光细胞系 | 人源 | 有 |
| C300021 | NCI-H82-Luc | 荧光细胞系 | 人源 | 有 |
| C300057 | NCI-H2122-Luc-EGFP | 荧光细胞系 | 人源 | 有 |
| C300058 | NCI-H1975-Luc-EGFP | 荧光细胞系 | 人源 | 有 |
| C300059 | PC-9-Luc-EGFP | 荧光细胞系 | 人源 | 有 |
| C400003 | NCI-H1975(L858R/T790M+C797S)-OSI-R | 耐药细胞系 | 人源 | 无 |
| C400004 | NCI-H1975-OSI-R | 耐药细胞系 | 人源 | 无 |
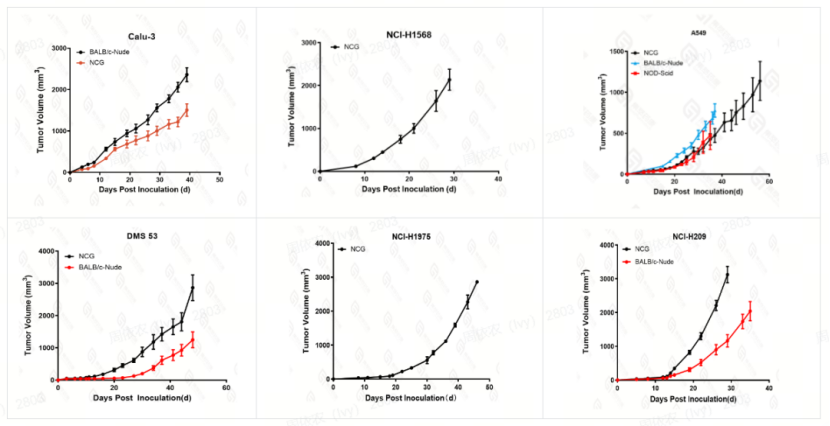
部分CDX细胞系成瘤数据如下:
同系移植瘤模型
同系移植瘤模型是将同一品系来源的肿瘤细胞植入相同遗传背景的免疫健全小鼠体内构建的模型。该模型的优势在于完整保留了宿主免疫系统,能够模拟肿瘤与免疫系统的相互作用过程,适用于免疫治疗药物的研究和肿瘤免疫微环境的探索。此外,同系模型由于遗传背景一致,实验结果的可重复性良好,同时成本相对较低,适合开展高通量药物筛选,是肺癌研究中不可或缺的重要工具,为揭示肺癌发生发展机制和开发新疗法提供了重要支持。
①同系移植瘤移植物资源
亚星yaxing868官网作为肿瘤研究领域的专业合作伙伴,致力于构建全球领先的鼠源肿瘤细胞资源平台,其中涵盖了野生型细胞系、人源化细胞系、荧光细胞系等肺癌细胞系资源,为行业提供高质量的肺癌研究一站式服务。
| 产品编号 | 产品名称 | 产品类别 | 细胞来源 | 成瘤数据 | 成瘤宿主小鼠 | 细胞基因修饰类型 |
| C100016 | LLC1 | 野生型细胞系 | 鼠源 | 有 | B6 | / |
| C100017 | KLN 205 | 野生型细胞系 | 鼠源 | 无 | / | / |
| C200096 | LLC-1-hSiglec15 | 人源化细胞系 | 鼠源 | 有 | B6-hSiglec15 | hSiglec15 (Tg)-mSiglec15(KO) |
| C200141 | LLC-1-hPDL1 | 人源化细胞系 | 鼠源 | 有 | B6 | hPDL1(Tg)-mPDL1(KO) |
| C200157 | LLC-1-hCD38 | 人源化细胞系 | 鼠源 | 无 | / | hCD38(KI)-mCD38(KO) |
| C300043 | LLC1-Luc | 荧光细胞系 | 鼠源 | 有 | B6 | / |
同系移植瘤宿主资源:肺癌药物靶点人源化小鼠模型
常规免疫健全小鼠因靶点蛋白结构(如PD-1/PD-L1、CD3等)与人类存在显著差异,导致针对人源靶点设计的肺癌靶向药物(如单抗、双抗)无法识别或结合小鼠靶点,从而无法进行临床前药效评估。通过基因编辑技术将小鼠靶点替换为人源基因,可精确模拟药物与靶点的相互作用过程,有效解决“人鼠不兼容”问题。这些模型可用于研究肺癌靶向药物在体内的药代动力学、药效动力学以及免疫相关不良反应等方面,为药物临床前研究提供重要工具。
亚星yaxing868官网部分肺癌药物靶点人源化模型可参考下表:
| 靶点 | 产品编号 | 产品名称 | 状态 |
| HER2 | T064739 | BALB/c-hCD3EDG/hHER2 | 胚胎冻存 |
| T057039 | BALB/c-hHER2-Tg | 活体 | |
| T009819 | BALB/c-hHER2 | 活体 | |
| EGFR | T064737 | BALB/c-hCD3EDG/hEGFR | 活体 |
| T056764 | BALB/c-hEGFR-T790M | 胚胎冻存 | |
| T009817 | BALB/c-hEGFR | 活体 | |
| T007732 | B6-hEGFR(Exon19 del) | 胚胎冻存 | |
| PD1 | T064918 | BALB/c-hPD1/hSIRPa-V2 | 活体 |
| T003095 | B6-hPD1 | 活体 | |
| T002726 | BALB/c-hPD1 | 活体 | |
| PD1,PD-L1 | T059704 | BALB/c-hPD1/hPDL1/hTIGIT/hPVRIG-V2 | 活体 |
| T054841 | BALB/c-hPD1/PDL1/hTIGIT/hCD226 | 活体 | |
| T050195 | BALB/c-hPD1/hPDL1/hCD47/hSIRPA | 活体 | |
| T037004 | BALB/c-hPD1/hPDL1/hTIGIT | 活体 | |
| T036974 | BALB/c-hPD1/hPDL1/hCD39 | 活体 | |
| T036652 | BALB/c-hPD1/hPDL1/hCD73 | 活体 | |
| T004025 | BALB/c-hPD1/hPDL1 | 活体 | |
| T004022 | B6-hPD1/hPDL1 | 活体 | |
| PD-L1 | T003455 | B6-hPDL1 | 活体 |
| T003260 | BALB/c-hPDL1 | 胚胎冻存 | |
| PD1,CTLA4 | T003826 | B6-hPD1/hCTLA4 | 活体 |
| T003720 | BALB/c-hPD1/hCTLA4 | 活体 | |
| CTLA4 | T055241 | BALB/c-hTIGIT/hCTLA4 | 胚胎冻存 |
| T003362 | B6-hCTLA4 | 胚胎冻存 | |
| T003361 | BALB/c-hCTLA4 | 胚胎冻存 | |
| VEGFA | T036939 | B6-Rho-hVEGFA-Tg | 活体 |
| T017803 | BALB/c-hVEGFA | 胚胎冻存 | |
| FLT3 | T054196 | BALB/c-hFLT3 | 胚胎冻存 |
| DLL3 | T069568 | B6-hDLL3 | 研发中 |
| T069567 | BALB/c-hCD3EDG/hDLL3 | 研发中 | |
| T069569 | B6-hCD3EDG/hDLL3 | 研发中 |
文中提及的组织/细胞资源仅用于亚星yaxing868官网相关服务项目,不单独出售;若有获取具体产品数据的需求,欢迎发送邮件至marketing@gempharmatech.com咨询!
参考资料
[1]Han, B., Zheng, R., Zeng, H., Wang, S., Sun, K., Chen, R., Li, L., Wei, W., & He, J. (2024). Cancer incidence and mortality in China, 2022. Journal of the National Cancer Center, 4(1), 47–53. https://doi.org/10.1016/j.jncc.2024.01.006
[2]https://www.cancer.org/cancer/types/lung-cancer/about/what-is.html
[3]https://www.lung.org/lung-health-diseases/lung-disease-lookup/lung-cancer/symptoms-diagnosis/lung-cancer-staging
[4]https://www.lungcancercenter.com/lung-cancer/stages/
[5]https://www.cancer.org/cancer/types/lung-cancer/treating-non-small-cell/targeted-therapies.html
[6]Kwon, M., & Berns, A. (2013). Mouse models for Lung Cancer. Molecular Oncology, 7(2), 165–177. https://doi.org/10.1016/j.molonc.2013.02.010
[7]Meuwissen, R., & Berns, A. (2005). Mouse models for human lung cancer. Genes & Development, 19(6), 643–664. https://doi.org/10.1101/gad.1284505
[8]https://www.lungcancercenter.com/treatment/
[9]Morgan, K. M., Riedlinger, G. M., Rosenfeld, J., Ganesan, S., & Pine, S. R. (2017). Patient-derived xenograft models of non-small cell lung cancer and their potential utility in personalized medicine. Frontiers in Oncology, 7. https://doi.org/10.3389/fonc.2017.00002
[10]Lallo, A., Schenk, M. W., Frese, K. K., Blackhall, F., & Dive, C. (2017). Circulating tumor cells and CDX models as a tool for preclinical drug development. Translational Lung Cancer Research, 6(4), 397–408. https://doi.org/10.21037/tlcr.2017.08.01
[11]https://www.merit.com/recognizing-lung-cancer-awareness-month/
[12]Karachaliou, N., Mayo, C., Costa, C., Magrí, I., Gimenez-Capitan, A., Molina-Vila, M. A., & Rosell, R. (2013b). KRAS mutations in lung cancer. Clinical Lung Cancer, 14(3), 205–214. https://doi.org/10.1016/j.cllc.2012.09.007
[13]Meuwissen, R., Linn, S. C., Linnoila, R. I., Zevenhoven, J., Mooi, W. J., & Berns, A. (2003). Induction of small cell lung cancer by somatic inactivation of both trp53 and RB1 in a conditional mouse model. Cancer Cell, 4(3), 181–189. https://doi.org/10.1016/s1535-6108(03)00220-4

