免疫治疗耐药有救了?ASCO 2025 PD1联合疗法捷报频传,人源化小鼠助力破局
近日,2025年美国临床肿瘤学年会(2025 ASCO)在芝加哥落下帷幕。会上,PD1联合免疫疗法捷报频传。今天就跟随亚星yaxing868官网一起走近相关研究报告,并认识人源化小鼠的积极作用。
肿瘤免疫治疗现状
PD-1/PD-L1抑制剂作为肿瘤免疫治疗的基石药物,已在临床应用中展现出显著的抗肿瘤活性和持久的治疗响应,适应症范围持续扩大。这类药物在应答患者中能够产生持久的抗肿瘤效应,已成为现代肿瘤治疗策略的核心支柱。然而,其总体临床响应率偏低的问题仍然亟待解决。
究其原因,这一困境源于多种复杂机制共同阻碍了癌症-免疫循环的正常运行,主要包括:肿瘤内在的抗原特性与免疫逃逸机制、高度免疫抑制的肿瘤微环境状态,以及T细胞功能性耗竭等多方面因素。单一的“松刹车”策略(即解除免疫抑制)往往难以提供足够动力来驱动整个癌症-免疫循环的顺畅运行。
基于这一认识,联合治疗策略已成为当前肿瘤免疫治疗领域的核心主题和发展方向。通过多靶点、多机制的协同作用,有望突破现有治疗瓶颈,为更多患者带来临床获益。
PD-1/CTLA-4双靶点协同突破
2025年3月,纳武利尤单抗(O药)联合伊匹木单抗(Y药)的双免疫治疗方案获得中国国家药品监督管理局批准,用于不可切除或转移性肝细胞癌的一线治疗,这标志着中国首个肝细一线双免疫联合疗法的诞生。在2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上,CheckMate 8HW临床试验公布了最新突破性数据:针对微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)晚期结直肠癌患者,O+Y双免方案展现出卓越疗效。
该研究结果显示:与O药单药治疗相比,双免联合组的客观缓解率(ORR)提升至71%(单药组58%),无进展生存期(PFS)尚未达到(单药组39.3个月);与化疗组相比,双免组PFS更是显著延长至54.1个月(化疗组仅5.9个月)。这些数据充分证实了双免联合策略的显著优势,不仅疗效显著优于单免治疗,更为重要的是为结直肠癌患者建立了全新的标准治疗方案,带来了突破性的治疗希望。
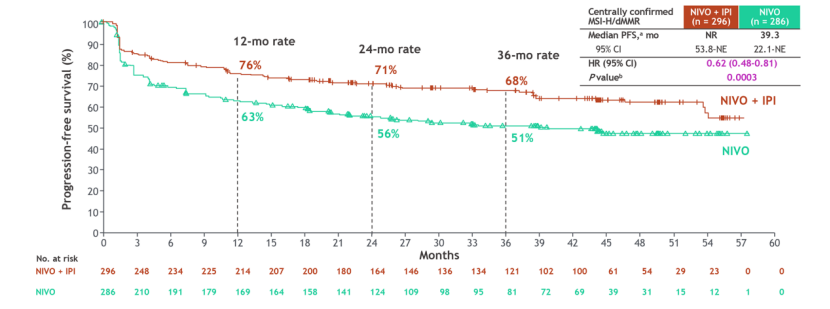
图1 CheckMate-8HW 研究O + Y双免治疗对比免疫单药O药队列 PFS 结果
数据来源:ASCO
PD1和CTLA4虽然同属免疫检查点分子,但在肿瘤免疫应答过程中发挥作用的失控特征存在显著差异。PD-1主要在免疫应答的效应阶段发挥作用,通过抑制炎症微环境中T细胞的活化;而CTLA-4则在免疫应答的初始阶段起关键调控作用,负向调节初始T细胞和记忆T细胞的活化过程。
O+Y联合治疗方案通过双重作用机制实现协同增效:一方面,PD1抑制解除T细胞功能抑制的同时,通过增强CD28共刺激信号促进初始T细胞的活化,扩大肿瘤新抗原特异性T细胞克隆的多样性;另一方面,CTLA-4阻断可显著削弱调节性T细胞(Treg)的免疫抑制功能,解除其对效应T细胞的抑制作用,从而实现“协同激活+解除抑制”的双重效果,产生显著的“1+1>2”协同抗肿瘤效应。
临床前数据显示,在BALB/c-hPD1/hPDL1/hCTLA4三基因人源化小鼠模型中,采用CT26-hPDL1结直肠癌细胞皮下移植模型进行药效评价。结果显示,Keytruda (抗PD1单抗)与Ipilimumab (抗CTLA-4单抗) 联合治疗组的抗肿瘤效果显著优于单药治疗组。该模型成功模拟了临床PD-1+CTLA4联合治疗的应答特征,为临床前评价PD1/PDL1与CTLA4抑制剂联用药方案提供了高度可靠的动物模型平台。
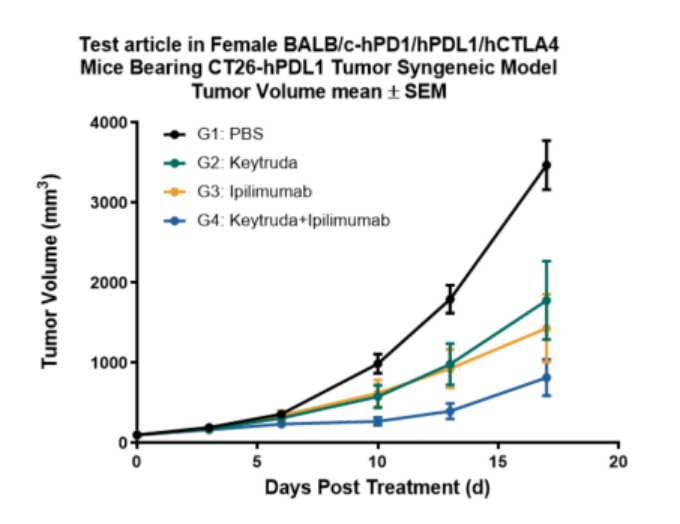
图2 药物在BALB/c-hPD1/hPDL1/hCTLA4人源化小鼠中的体内抗肿瘤效果
PD1+LAG3联用扩大受益人群
除PD-1/CTLA-4组合以外,PD-1/LAG-3联合策略同样展现出卓越的临床价值。LAG-3作为T细胞耗竭的关键抑制性手提,其在肿瘤微环境中的高表达与免疫治疗耐药密切相关。基础研究证实,通过基因敲除或抗体阻断LAG3功能,可显著增强抗原特异性CD8+T细胞的浸润和效应功能。
这一机制已转化为临床获益:2022年3月,FDA批准纳武利尤单抗联合Relatlimab(Opdualag,百时美施贵宝)用于≥12岁不可切除或转移性黑色素瘤患者。最新公布的INSIGHT-003研究数据显示,Eftilagimod alpha(efti)联合帕博利珠单抗的中位无进展生存期(PFS)达12.7个月,总生存期(OS)达32.9个月,显著优于帕博利珠单抗联合化疗的历史数据。尤为重要的是,该方案的疗效不受PD-L1表达水平(TPS评分)限制,有望显著拓宽PD1抑制剂的适用人群。
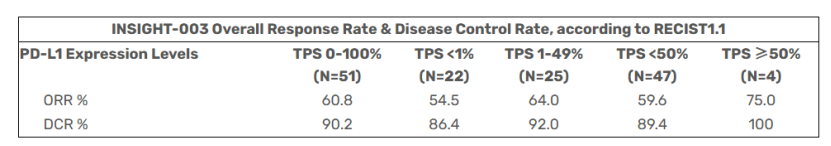
图3 INSIGHT-003的总体缓解率和疾病控制率结果
数据来源(Immutep官网)
在B6-hPD1/hLAG3双基因人源化小鼠模型中,研究人员通过皮下移植B16F10黑色素瘤细胞建立肿瘤模型,与Anti-PD1单药组与Relatlimab单药组相比,Anti-PD1与 Relatlimab联合给药组展现出更为显著的抗肿瘤效应及更长的生存周期。该模型能够精准再现LAG3扩大PD1响应人群的临床特征,是评估PD1+LAG3抑制剂的理想动物模型。
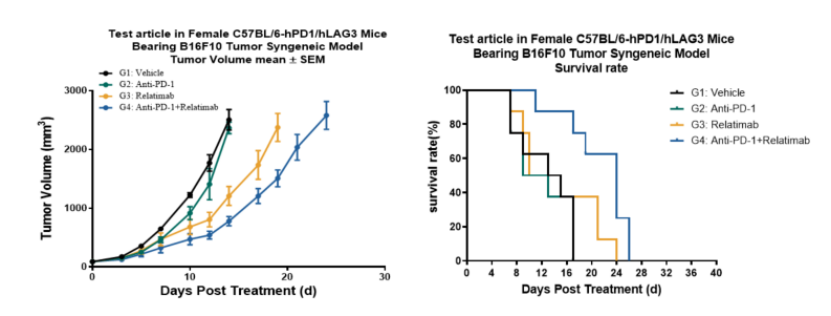
图4 药物在B6-hPD1/hLAG3人源化小鼠中的体内抗肿瘤效果
Keytruda 联合+Trodelvy强强协作联合
对于PDL1+(CPS≥10)的三阴乳腺癌,免疫联合化疗是目前标准一线治疗方案,中位无进展生存期(PFS)可达9.7个月。此次2025 ASCO公布的ASCENT04研究进一步升级了治疗策略,采用免疫联合ADC(Keytruda联合Trodelvy)的方案,其中Trodelvy作为全球首款获批的TROP-2 ADC药物备受关注。研究数据显示,免疫联合ADC对比传统化疗联合免疫方案,PFS呈现显著优势(11.2个月 vs. 7.8个月),风险比(HR)为 0.65(P<0.001),这一结果预示该方案有望成为新的三阴乳癌一线治疗标准。尽管总生存期(OS)数据尚未成熟,但已显现获益趋势(HR 0.89)。
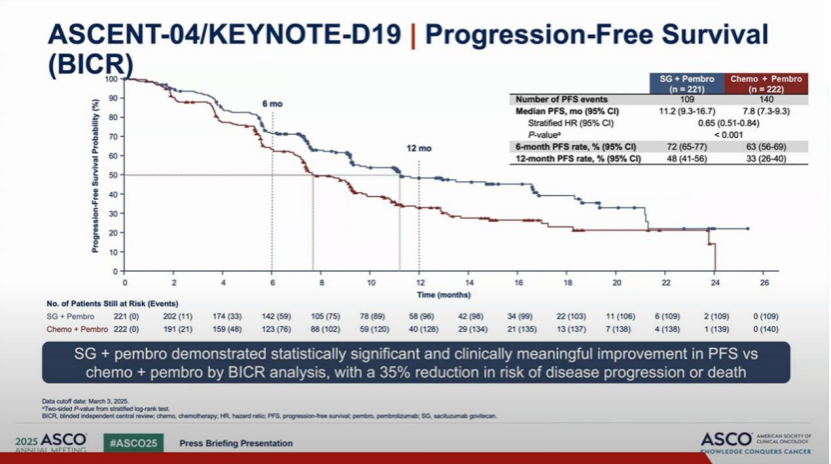
图5 ASCENT04研究“免疫联合ADC”对比“免疫+化疗”PFS结果
数据来源:ASCENT04 asco daliy news
联合化疗、放疗(尤其是放疗增敏策略)、特定靶向药物(如多激酶抑制剂)以及光热/光动力疗法等多种治疗手段。这些干预方式可通过杀死肿瘤细胞,触发大量肿瘤抗原(类似“疫苗”效应)和“危险信号”(DAMPs,损伤相关分子模式)的释放,激活树突状细胞,显著增强免疫治疗的响应效果。
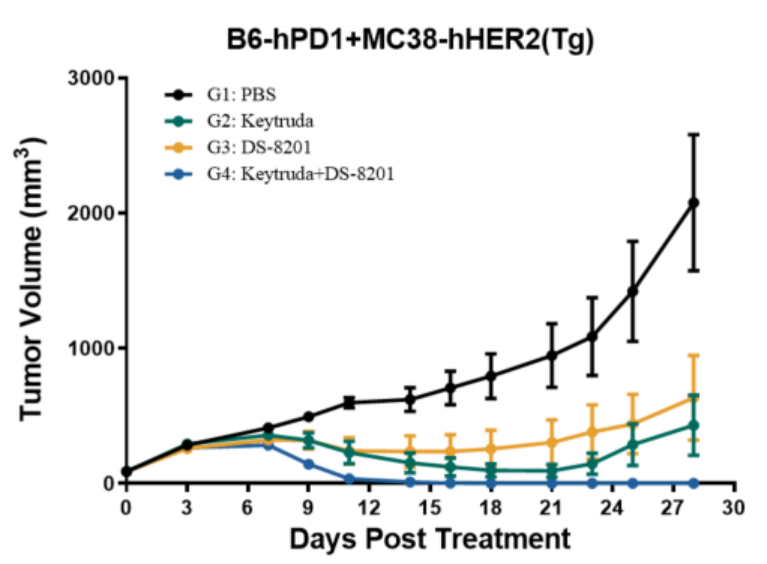
图6 药物在B6-hPD1人源化小鼠中的体内抗肿瘤效果
在B6-hPD1小鼠皮下移植MC38-hPDL1结直肠癌细胞的模型研究中,Keytruda (抗 PD1抗体anti-PD1)与DS-8201 (HER2 ADC) 联合给药组相较于二者单药组展现,表现出更为优异的抗肿瘤效果。该模型中单药治疗已呈现药效显著药效,联合用药效果进一步增强,是ICIs联合疗法研究的理想动物模型。
亚星yaxing868人源化小鼠模型加速新药研发
针对前景可期的免疫联合疗法,亚星yaxing868官网依托领先强大的基因编辑技术与完善的体内外药效研究平台,成功构建了覆盖多种遗传背景、靶向多个关键免疫检查点的人源化小鼠模型系列,并开发了与之配套的、针对不同药物作用机制的功能性评价模型体系,可针对不同药物作用机制提供精准评估,为新药研发提供强力支撑。欢迎咨询合作!

